- 유럽의약품청, 노보노디스크 GLP-1 약물 안전성 검토 예고
- 식약처, “관련 업체 정보 수집 요청 및 검토 후 방안 강구”
최근 유럽의약품청이 비만약으로 각광받고 있는 ‘삭센다’(성분명 리라글루티드), ‘오젬픽’(성분명 세마글루티드) 등 노보노디스크가 개발한 GLP-1 약물과 자살 관련 부작용 사이의 인과관계를 조사하겠다고 공표한 가운데 식품의약품안전처도 이를 예의주시하고 있어 관심이 모이고 있다.
제약 전문 매체인 피어스파마(Firece Pharma)는 지난 10일(현지시간) 유럽에서 노보노디스크 GLP-1 약물의 자살 위험 가능성이 보고됐으며, 유럽의약품청(EMA)이 이러한 사항을 인지하고 재검토하고 있다고 밝혔다.
아이슬란드에서 노보노디스크의 당뇨병 및 비만 치료제를 복용한 사용자의 자살 충동 사례 2건과 자해 사례 1건이 보고되면서 EMA가 검토에 나섰다는 것이다. 구체적으론 EMA 약물감시위해평가위원회(Pharmacovigilance Risk Assessment Committee, PRAC)가 노보노디스크의 ‘리라글루티드’ 및 ‘세마글루티드’ 성분 제제의 사용과 부작용 사이의 인과관계를 조사할 예정이라고 밝혔다.
PRAC가 이달 3일 발표한 주관 회의 보고서에는 구체적인 품목들을 명시하고 있다. 라라글루티드 성분 제제로는 비만 치료제 ‘삭센다’와 당뇨병 치료제 ‘빅토자’ 및 인슐린과의 복합체인 ‘줄토피’가 포함되어 있으며, 세마글루티드 성분 제제로는 당뇨병 치료제 ‘오젬픽’과 경구제 ‘리벨러스’, 비만치료제인 ‘위고비’가 포함됐다.
또 EMA는 인기 있는 GLP-1 계열의 모든 약물로 검토를 확대할지 여부를 고민하고 있으며, 여기에는 급성장 중인 릴리의 ‘마운자로’(성분명 터제파타이드)도 포함될 것으로 전해져 파장이 더욱 확대될 것으로 보인다.
해당 소식이 국내에도 전해지자 식품의약품안전처도 빠르게 대처에 나서는 모양새다. EMA의 공식 자료를 확인한 식약처는 관련 업체에 해당 관련 정보를 수집하기 위해 나서고 있다.
식약처 관계자는 “이후 제출된 자료, 국외 조치 현황, 국내 이상 사례 모니터링 등을 검토해 필요한 조치 방안을 강구할 예정”이라고 덧붙였다.
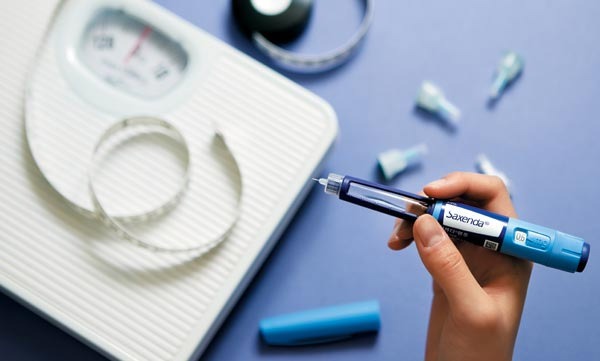
현재 국내에는 위에서 언급된 노보노디스크의 모든 품목이 식약처 허가를 받은 상황이다. 다만 세마글루티드 제제의 경우, 아직 국내 유통이 시작되지 않아 리라글루티드 제제에 대한 모니터링만 가능한 상황이다. 여기에 더해 비만치료제로 국내에서 폭발적으로 사용이 증가되고 있다는 ‘삭센다’는 비급여 품목에 해당해 사용자에 대한 모니터링이 제대로 이뤄질 수 있을지 여부도 의문이다.
삭센다는 국내에서 작년 한 해 590억 원에 달하는 매출을 올리며 전년 대비 60%가 넘는 성장률을 보였다. 하지만 개원가에서의 무분별한 허초 사용 및 불법 유통 등으로 국내 사용자들의 모니터링은 사실상 불가능한 상황이다. 때문에 일각에선 제약사 보고에 의존한 이상사례 정보 수집만으로 식약처가 삭센다와 실제 부작용 사이의 연관성을 확인할 수 있을지 의문도 제기하고 있다.
<저작권자 ⓒ 의사나라뉴스, 무단 전재 및 재배포 금지>
서유림 다른기사보기