- 삭센다를 이을 후속 품목인 '세마글루타이드'의 빠른 도입을 위해 한국형 맞춤 허가 임상시험 시작
- 지난 6월 미국 식품의약국(FDA)으로부터 비만 치료에 품목허가 승인
비만 치료제 업계에서 국내 매출 1위를 기록하고 있는 ‘삭센다(성분명 리라글루타이드)'의 제약회사 노보노디스크가 1위 굳히기에 나섰다. 삭센다를 이을 후속 품목인 '세마글루타이드'의 빠른 도입을 위해 한국형 맞춤 허가 임상시험을 시작한 것이다.
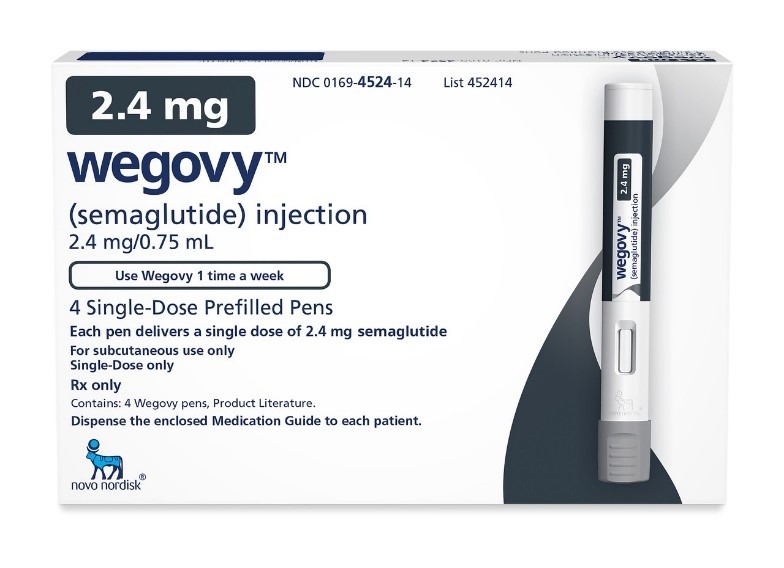
식품의약품안전처는 지난 9월 30일 노보노디스크가 신청한 '세마글루타이드 2.4mg 주사제(미국 상품명 '위고비')'의 3b상 임상시험 계획을 승인했다. 이 임상시험은 아시아인 비만 환자 150명을 대상으로 주 1회 세마글루타이드 2.4mg의 유효성 및 안전성을 평가하기 위한 이중맹검, 무작위 위약 대조 연구이다.
눈여겨볼 부분이 있다면, 아시아인을 대상으로 하는 만큼 현지 가이드라인에 따라 비만의 기준을 '체질량지수(BMI) 25 kg/m2 이상'으로 설정했다는 점이다. 또한 대상 환자 150명 중 85명이 국내 환자로 진행된다. 사실상 한국형 맞춤 허가 임상시험으로 진행되는 것이다.
'세마글루타이드'는 노보노디스크가 자사의 '리라글루타이드' 후속약으로 개발한 GLP-1 유사체다. '리라글루타이드'가 저용량(상품명 '빅토자')으로 제2형 당뇨병 치료에 먼저 개발되고 뒤이어 고용량(상품명 '삭센다')으로 비만 치료에 사용된 것처럼, '세마글루타이드' 역시 저용량 제품인 '오젬픽'이 당뇨병 치료에 먼저 개발됐다.
이후 노보노디스크는 고용량 세마글루타이드의 비만 치료 임상시험을 3상까지 마치고, 지난 6월 미국 식품의약국(FDA)으로부터 비만 치료에 품목허가 승인을 받았다. 고용량 세마글루타이드는 글로벌 3상 임상 프로그램(STEP)에서 68주에 걸친 기저치 대비 평균 17~18%의 체중 감소 효과를 보이며, 기존 품목인 '삭센다'보다 개선된 효능을 입증했다.
하지만 STEP 임상 프로그램이 대부분 서양인을 대상으로 진행된 만큼 비만 환자의 기준이 'BMI 30 kg/m2 이상'이거나 'BMI 27 kg/m2 이상이며, 1개 이상의 체중 관련 동반질환을 가진 과체중'으로 설정돼 아시아인에게는 적합하지 않다는 제한점이 있어 왔다.
실제 STEP 임상 프로그램 참여한 환자의 평균 BMI는 37~38 kg/m2 정도로 고도로 비만인 환자라는 점에서 국내 임상 환경과는 더욱 동떨어진 상황이다. 이같은 지적은 '삭센다'가 국내 비만 시장에 출시될 당시에도 지속적으로 제기된 문제이기도 하다.
이에 노보노디스크는 애초에 국내 허가 임상시험의 비만 기준을 현지 가이드라인에 따라 'BMI 25 kg/m2 이상'으로 잡고 진행키로 한 것이다. 다만, 유효성을 평가하는 기간은 치료 44주 차로 설정해 글로벌 임상시험보다는 치료기간(68주)을 단축시켰다.
1차 유효성 평가변수는 44주 차 기저치 대비 체중 변화 및 5% 이상의 체중 감소 달성 여부이며, 2차 평가변수는 44주 차 기저치 대비 10%, 15% 이상의 체중 감소 달성 여부 및 허리둘레 변화로 설정됐다. 해당 임상시험은 분당서울대병원 내분비내과 임수 교수 주도로 이뤄지며, 완료 시기는 2023년 5월로 예정돼 있다.
한편, 노보노디스크는 '세마글루타이드'를 경구제로도 개발해 2019년 9월 미국에서 제2형 당뇨병 치료에 품목허가(상품명 '라이벨서스')를 받았으며, 지난 4월에는 비만 치료에 대한 새로운 임상시험 계획을 발표하고 현재 3상 임상시험을 진행 중에 있다.
<저작권자 ⓒ 의사나라뉴스, 무단 전재 및 재배포 금지>
김정수 다른기사보기